Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности
На нашем сайте можно бесплатно скачать Руководящий документ СП 1.2.036-95 в удобном формате. Узнать актуальный статус документа «Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности» на 2016 год.
Скрыть дополнительную информацию

Страница 1

Страница 2

Страница 3

Страница 4

Страница 5

Страница 6

Страница 7

Страница 8

Страница 9

Страница 10

Страница 11

Страница 12

Страница 13

Страница 14

Страница 15

Страница 16

Страница 17

Страница 18

Страница 19

Страница 20

Страница 21

Страница 22

Страница 23

Страница 24

Страница 25

Страница 26

Страница 27

Страница 28

Страница 29

Страница 30
Страница 31

Страница 32

Страница 33

Страница 34

Страница 35

Страница 36

Страница 37

Страница 38

Страница 39

Страница 40

Страница 41

Страница 42

Страница 43

Страница 44

Страница 45
Страница 46
Страница 47

Страница 48
Страница 49

Страница 50
Страница 51
Страница 52
Страница 53

Страница 54
Страница 55
Страница 56
Страница 57

Страница 58
Страница 59

Страница 60

Страница 61
Страница 62

Страница 63
Страница 64

Страница 65
Страница 66

Страница 67
Страница 68
Страница 69

Страница 70

Страница 71

Страница 72

Страница 73

Страница 74

Страница 75

Страница 76
Страница 77
Страница 78
Страница 79
Страница 80

Страница 81
Государственная система санитарно-эпидемиологического
нормирования Российской Федерации
Федеральные санитарные правила, нормы и гигиенические
нормативы
1.2. ЭПИДЕМИОЛОГИЯ
Порядок учета, хранения, передачи и
транспортирования микроорганизмов I — IV
групп патогенностИ
Санитарные правила
СП 1.2.036-95
Госкомсанэпиднадзор России
Москва 1996
1. Разработаны:
Противочумным центром Госкомсанэпиднадзора России (Кюрегян А.А., Головченко Н.Н., Пономарева Т.Н., Ошерович А.М., Королев Ю.С.);
Российским научно-исследовательским противочумным институтом «Микроб» (Дроздов И.Г., Плотников О.П., Васенин А.С., Кокушкин А.М.);
Институтом вирусологии им. Д.И. Ивановского (Фадеева Л.Л.);
Государственным НИИ стандартизации и контроля медицинских биологических препаратов им. Л.Л. Тарасовича (Шобухова Т.С.).
2. Утверждены и введены в действие Постановлением
Госкомсанэпиднадзора России от 28 августа 1995 г. № 14.
3. Вводятся взамен «Положения о порядке учета, хранения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактерийных токсинов, ядов биологического происхождения», утвержденного Минздравом СССР 18 мая 1979 г.
СОДЕРЖАНИЕ
|
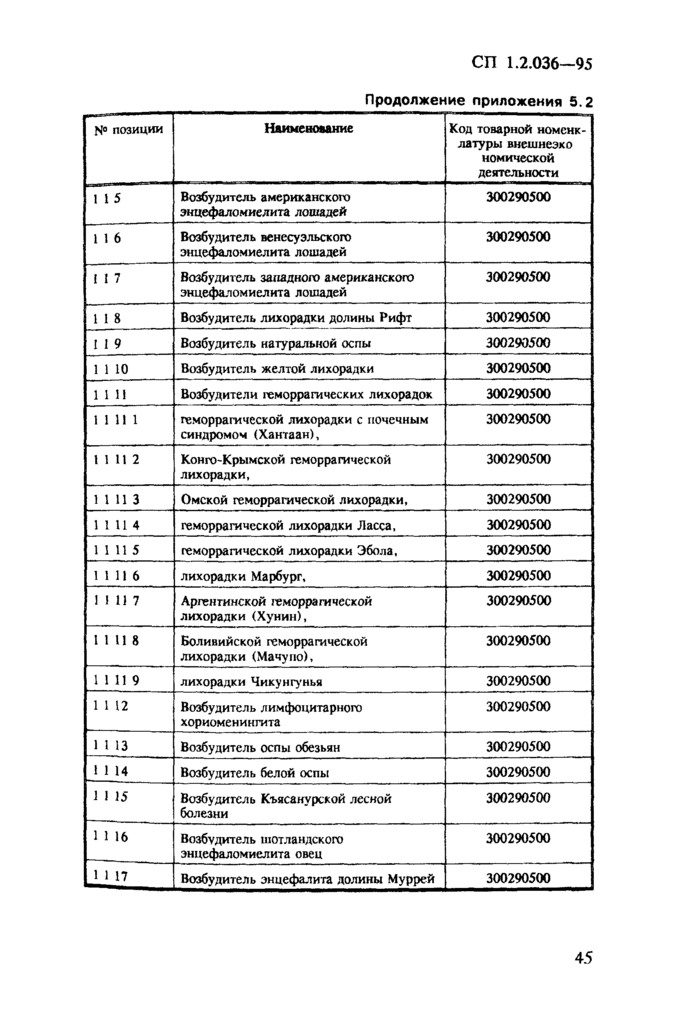
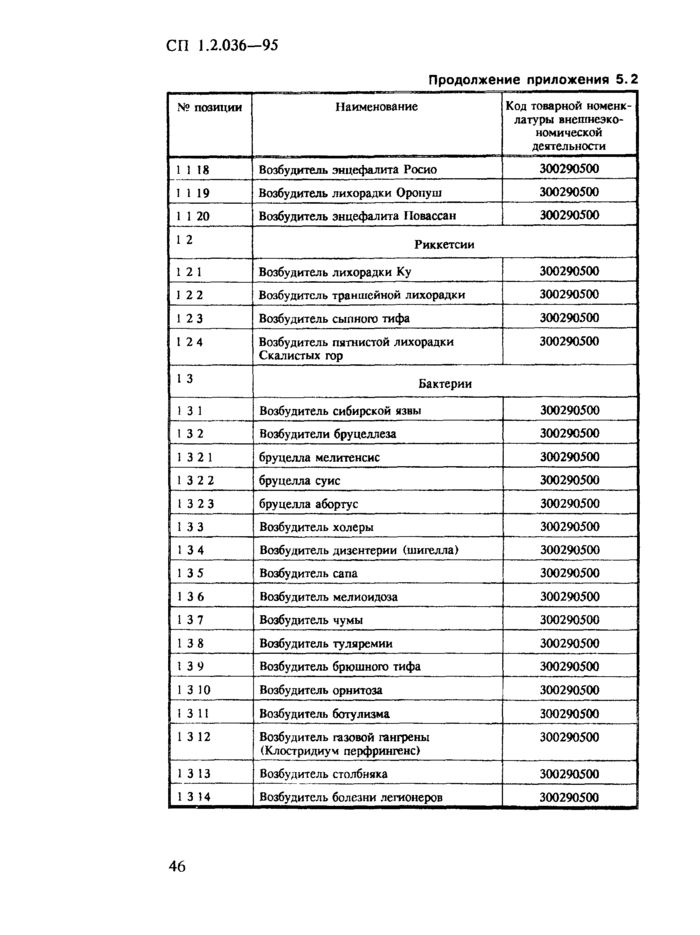
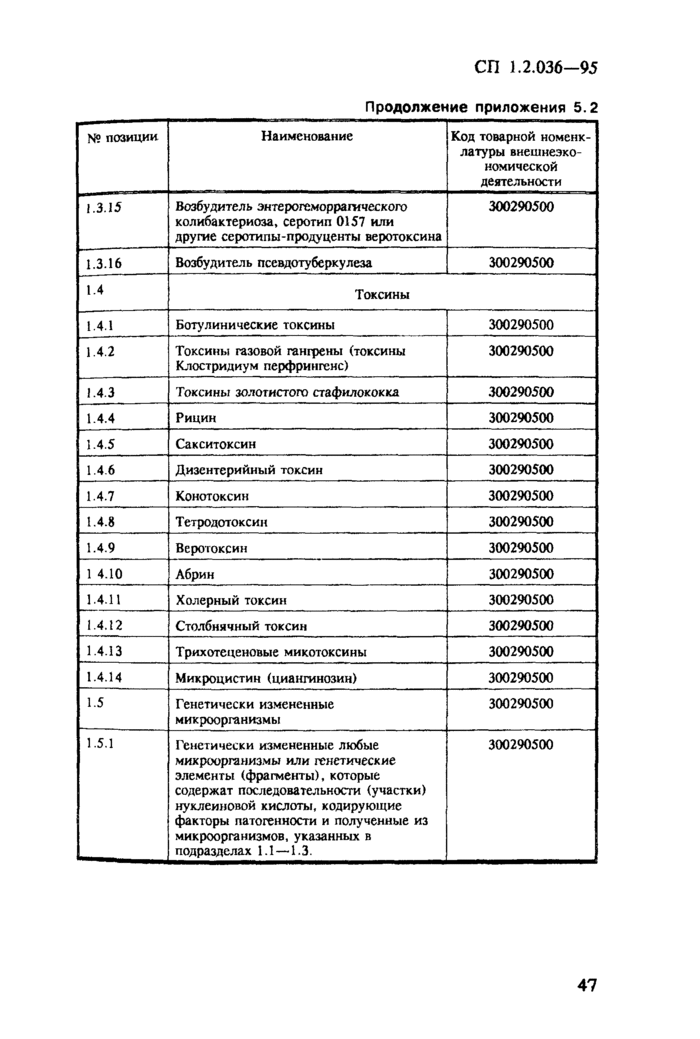
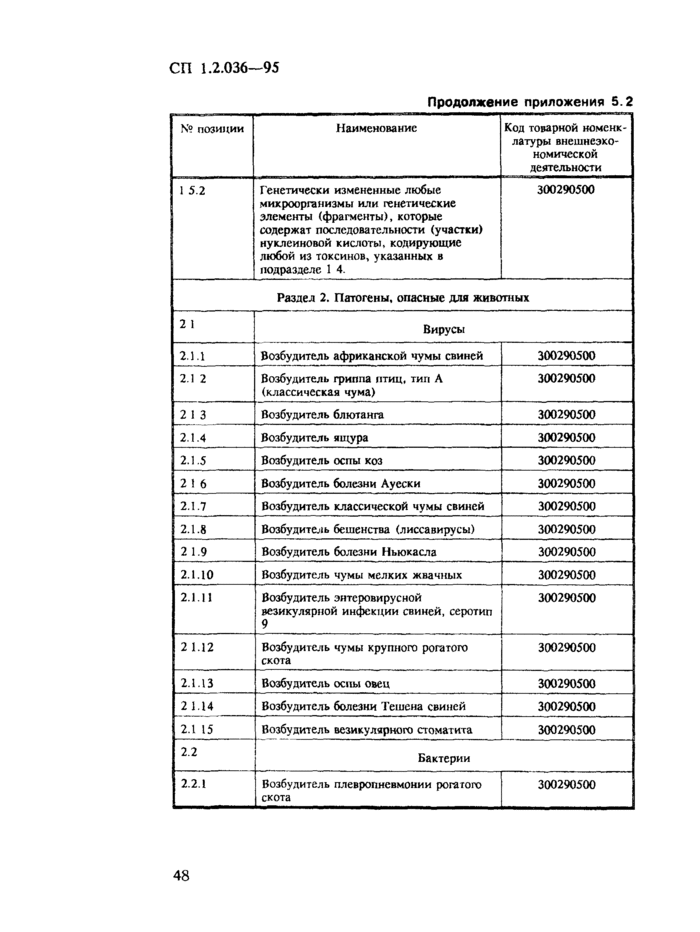
1. Область применения. 2 2. Нормативные ссылки. 3 3. Требования к порядку учета, хранения, отпуска и транспортирования ПБА I — IV групп. 3 3.1. Общие требования. 3 3.2. Требования к учету и хранению ПБА.. 4 3.3. Требования к порядку передачи ПБА внутри организации. 6 3.4. Требования к порядку передачи ПБА за пределы организации. 6 3.5. Требования к порядку передачи ПБА в зарубежные страны.. 7 4. Организация контроля. 8 Приложение 5.1 Журнал регистрации патогенных биологических агентов, поступивших для исследования (идентификации) и хранения. 9 Приложение 5.2 Список возбудителей заболеваний (патогенов) человека, животных и растений, их генетически измененных форм, фрагментов генетического материала и оборудования, которые могут быть применены при создании бактериологического (биологического) и токсинного оружия, экспорт которых контролируется и осуществляется по лицензиям (извлечение) 21 Приложение 5.3 Положение о порядке контроля за экспортом из Российской Федерации возбудителей заболеваний (патогенов) человека, животных и растений, их генетически измененных форм, фрагментов генетического материала и оборудования, которые могут быть применены при создании бактериологического (биологического) и токсинного оружия. 24 Приложение 5.4 Классификация патогенных для человека микроорганизмов. 28 Приложение 5.5 Перечень организаций, на базе которых функционируют специализированные коллекции ПБА I — IV групп. 35 Приложение 5.6 Разрешение на транспортирование спецгруза. 37 Приложение 5.7 Знаки биологической безопасности и рисунки. 37 |
УТВЕРЖДЕНО
Постановлением Госкомсанэпиднадзора
России от 28.08.95 № 14
Дата введения — с момента опубликования.
1.2. ЭПИДЕМИОЛОГИЯ
Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности
Order of calculation, storage, transfer and transportation of the microorganisms of I — IV pathogenicity groups
Санитарные правила
СП 1.2.036-95
1. Область применения
Настоящие правила подготовлены в соответствии с «Положением о Государственном санитарно-эпидемиологическом нормировании», утвержденным постановлением Правительства Российской Федерации от 05.06.94 № 625, и устанавливают требования к порядку учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности (далее — патогенные биологические агенты — ПБА* I — IV групп). (Приложение 5.4.)
* Понятие «патогенные биологические агенты» включает бактерии, вирусы, риккетсии, грибы, простейшие, микоплазмы, токсины и яды биологического происхождения или материал, подозрительный на их содержание, а также любые микроорганизмы, включающие фрагменты генома названных ПБА и представляющие опасность для человека.
Требования правил обязательны для выполнения всеми организациями на территории России независимо от их ведомственной принадлежности и форм собственности, а также юридическими и физическими лицами, проводящими работы с использованием ПБА I — IV групп.
Правила устанавливают единый порядок учета, хранения, передачи ПБА и направлены на обеспечение личной и общественной безопасности при их транспортировании, а также исключение несанкционированной передачи и безучетного хранения.
2. Нормативные ссылки
В настоящих правилах использованы ссылки на следующие нормативные документы.
2.1. Закон РСФСР «О санитарно-эпидемиологическом благополучии населения». Ведомости Верховного Совета РСФСР. 1991. № 20. С. 641.
2.2. Распоряжение Президента Российской Федерации «О контроле за экспортом из Российской Федерации возбудителей заболеваний (патогенов) человека, животных и растений, их генетически измененных форм, фрагментов генетического материала и оборудования, которые могут быть применены при создании бактериологического (биологического) и токсинного оружия» от 14 июня 1994 года, № 298-рп.
2.3. Постановление Правительства Российской Федерации «Положение о порядке контроля за экспортом из Российской Федерации возбудителей заболеваний (патогенов) человека, животных и растений, их генетически измененных форм, фрагментов генетического материала и оборудования, которые могут быть применены при создании бактериологического (биологического) и токсинного оружия» от 26 сентября 1994 г., № 1098.
2.4. Санитарные правила по безопасности работ с микроорганизмами. Ч. 1. Порядок выдачи разрешения на работу с микроорганизмами I — IV групп патогенности и рекомбинантными молекулами ДНК. СП 1.2.006-93. Госкомсанэпиднадзор России, Москва, 1993.
2.5. Санитарные правила «Безопасность работы с микроорганизмами I — II групп патогенности». СП 1.2.011-94. Госкомсанэпиднадзор России, Москва, 1994.
2.6. «Правила устройства, техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены при работе в лабораториях (отделениях, отделах) санитарно-эпидемиологических учреждений системы министерства здравоохранения СССР» от 20 октября 1981 г. МЗ СССР, Москва, 1981.
2.7. «Правила техники безопасности, производственной санитарии и санитарно-противоэпидемического режима для предприятий по производству бактерийных и вирусных препаратов» от 30 августа 1979 г. МЗ СССР, Москва, 1980.
3. Требования к порядку учета, хранения, отпуска и транспортирования ПБА I — IV групп
3.1. Общие требования
3.1.1. Работу с ПБА I — IV групп проводят только в организациях, имеющих разрешение на право работы с ними, выданные в соответствии с Санитарными правилами — СП 1.2.006-93.
3.1.2. Работа с ПБА I — II групп должна проводиться в соответствии с Санитарными правилами — СП 1.2.011-94.
3.1.3. Работа с ПБА III — IV групп должна проводиться в соответствии с «Правилами устройства, техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены при работе в лабораториях (отделениях, отделах) санитарно-эпидемиологических учреждений системы Министерства здравоохранения СССР», действующими на территории Российской Федерации.
3.1.4. Работа предприятий по производству бактерийных и вирусных препаратов определяется «Правилами техники безопасности, производственной санитарии и санитарно-противоэпидемического режима для предприятий по производству бактерийных и вирусных препаратов».
3.1.5. В подразделениях, изготовляющих вакцины, обслуживающих водопроводы, пищевые предприятия, а также предприятия, производящие продукцию медицинского назначения (антибиотики, лекарственные, косметические средства и другие коммерческие препараты), запрещается иметь ПБА I — IV групп и проводить микробиологические (бактериологические, вирусологические, микологические и др.) исследования, связанные с изучением первично выделенных культур, подозрительных на наличие возбудителей I — IV групп.
3.1.6. Производственным подразделениям предприятий, контролирующим готовую продукцию, разрешается иметь только коллекцию типовых культур, предусмотренных нормативно-технической документацией.
3.1.7. ПБА I — IV групп, выделенные при диагностических и иных исследованиях в лабораториях, не имеющих права на работу с ними, должны быть переданы в специализированные организации, определяемые соответствующими министерствами и ведомствами.
3.1.8. В организациях, систематически работающих с ПБА I — IV групп, разрешается иметь коллекции типовых, авторских и депонированных штаммов для научной работы, производства и диагностических целей.
3.1.9. Для централизованного учета, хранения и депонирования штаммов микроорганизмов, имеющихся в организациях на территории России, министерства и ведомства определяют научно-исследовательские институты, на базе которых организуются специализированные коллекции с информационными функциями. (Отдельные специализированные коллекции перечислены в приложении 55.).
3.1.10. О выделении всех ПБА I — II групп и атипичных ПБА III — IV групп необходимо информировать соответствующие специализированные коллекции и по согласованию с их руководителями передавать эти ПБА в коллекции.
ПБА I — II групп, не подлежащие передаче в коллекции, уничтожают по распоряжению руководителя организации, а ПБА III — IV групп — руководителя подразделения.
3.1.11. Варианты ПБА, полученные в ходе выполнения научно-исследовательских работ, хранят в специализированных коллекциях как охраноспособные (объект патентования) или авторские (имеющие научное значение).
3.1.12. Производственные и эталонные ПБА I — IV групп разрешается получать только в специализированных коллекциях.
3.1.13. Ответственным за правильное хранение коллекционных ПБА является лицо, определяемое руководителем организации.
3.2. Требования к учету и хранению ПБА
3.2.1. Подразделения, проводящие диагностические исследования по выделению ПБА I — IV групп или работающие с ними, должны вести учет движения и хранения ПБА по следующим формам* (далее ф.):
* Формы учетных документов представлены в приложении 5.1.
· ф. № 512/у — журнал регистрации патогенных биологических агентов, поступивших для исследования (идентификации) и хранения;
· ф. № 513/у — журнал учета выделенных штаммов микроорганизмов;
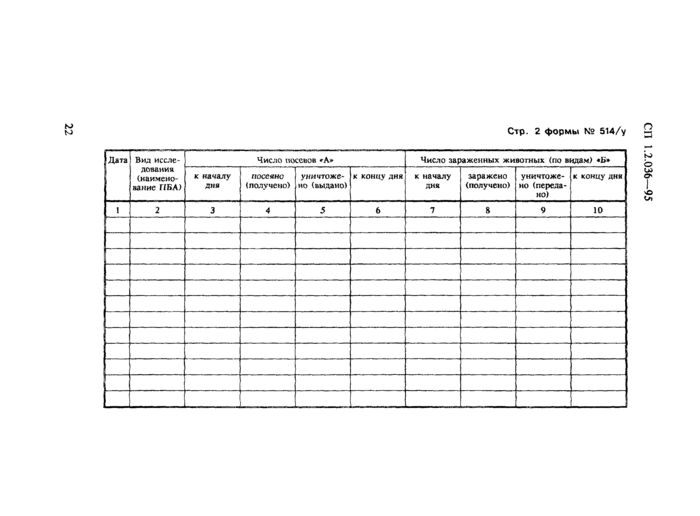
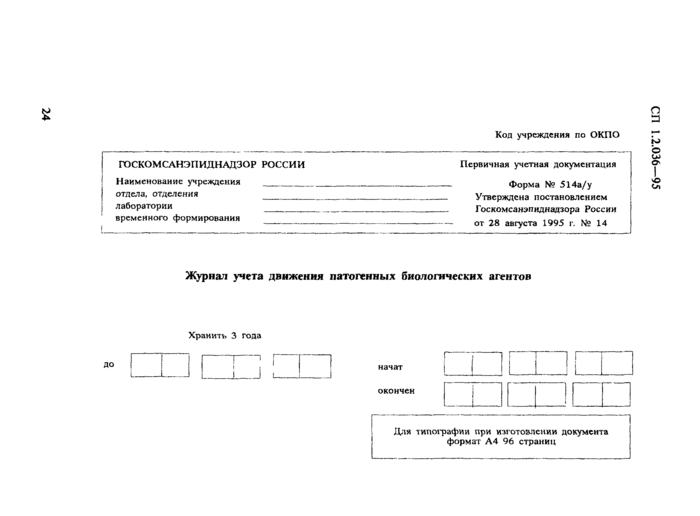
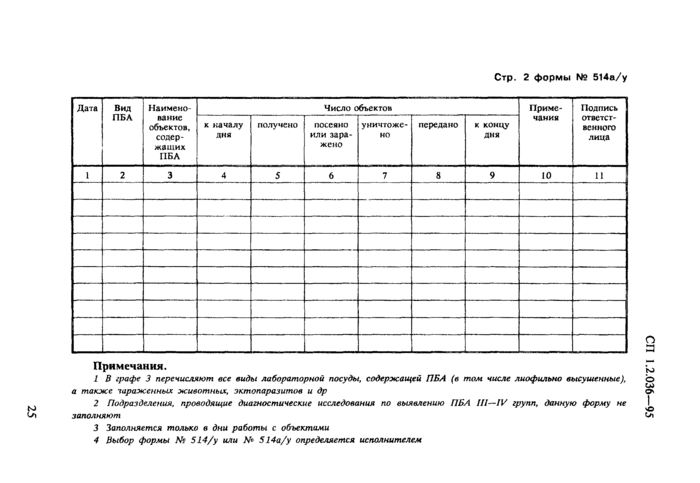
· ф. № 514/у (514а/у) — журнал учета движения патогенных биологических агентов;
· ф. № 518/у — журнал учета ПБА, находящихся в рабочей коллекции;
· ф. № 520/у — журнал обеззараживания патогенных биологических агентов.
3.2.2. Все коллекции должны вести учет ПБА I — IV групп по следующим формам:
· ф. № 512/у — журнал регистрации патогенных биологических агентов, поступивших для исследования (идентификации) и хранения;
· ф. № 514/у (514а/у) — журнал учета движения патогенных биологических агентов;
· ф. № 515/у — инвентарный журнал коллекционных патогенных биологических агентов;
· ф. № 516/у — журнал выдачи патогенных биологических агентов;
· ф. № 517/у — карта индивидуального учета коллекционного патогенного биологического агента N;
· ф. № 518/у — журнал учета ПБА, находящихся в рабочей коллекции;
· ф. № 519/у — журнал лиофилизации патогенных биологических агентов;
· ф. № 520/у — журнал обеззараживания патогенных биологических агентов.
Движение коллекционных ПБА I — IV групп регистрируют в ф. № 514/у (514а/у): для I — II групп — по каждому виду отдельно, а III — IV — суммарно по роду.
3.2.3. Штаммы, используемые для диагностических целей, а также вакцинные и производственные учитывают как коллекционные.
3.2.4. Окончательное обозначение поступившим штаммам присваивают только коллекции. Под особым обозначением в соответствующей графе журнала (ф. № 515/у) и карте (ф. № 517/у) указывают название и номер, под которым штамм поступил в данную коллекцию.
3.2.5. Присвоенное коллекционному штамму обозначение (номер, код) не должно меняться при его передаче.
В случае гибели (уничтожения) штамма его обозначение запрещается присваивать вновь поступившим штаммам.
3.2.6. В подразделениях, проводящих экспериментальные работы с ПБА I — IV групп, ведется учет по фф. № 514/у (514а/у) и № 518/у.
3.2.7. Уничтожение штамма ПБА I — II групп во всех подразделениях и III — IV в коллекциях следует оформлять актом (ф. № 522/у).
3.2.8. Все журналы по учету ПБА I — IV групп должны быть пронумерованы постранично, прошнурованы, скреплены печатью и храниться у лица, ответственного за их ведение.
Записи в журналах должны соответствовать другой документации: актам уничтожения, передачи и т. п.
Все оконченные журналы (карты) учетных форм, перечисленных в пп. 3.2.1; 3.2.2; 3.2.6, следует хранить в подразделениях в течение 3 лет. Формы №№ 514/у (514а/у) и 520/у необходимо уничтожать с составлением акта. В диагностических и исследовательских лабораториях фф. №№ 512/у, 513/у, 518/у и журналы идентификации необходимо сдавать в архив. Во всех коллекциях в архив сдавать оконченные журналы фф. 512/у, 515/у, 516/у, 517/у, 518/у и 519/у. Сроки хранения журналов в архиве устанавливаются приказом Госкомсанэпиднадзора России.
3.2.9. Емкости, содержащие ПБА, должны иметь четкие, несмываемые надписи или прочно наклеенные этикетки с обозначением названия ПБА, номера штамма и даты лиофилизации (пересева).
На емкостях с токсинами должна быть дополнительная маркировка красным цветом правого нижнего угла этикетки.
3.2.10.ПБА I — IV групп в коллекциях должны храниться в лиофилизированном или замороженном состоянии, на плотных или жидких питательных средах, а также в виде суспензий органов и тканей в консерванте.
3.2.11.В подразделениях научно-исследовательских институтов допускается хранение в лиофилизированном состоянии ПБА III — IV групп (бактерии и риккетсии), II — IV групп (вирусы), а также хранение авирулентных, комиссионно проверенных ПБА I — II групп, список которых утверждает руководитель организации.
Вскрытие ампул с лиофилизированными ПБА I — II групп оформляется документально (ф. № 521/у).
3.2.12.ПБА следует хранить в холодильнике или несгораемом шкафу (сейфе) раздельно по группам. Совместное содержание ПБА различных групп допускается при условии хранения их в отдельных небьющихся емкостях с закрывающейся крышкой. Емкости опечатывают, снаружи или внутри их помещают список с перечнем и количеством хранящихся ПБА.
3.2.13.ПБА, служащие основой для приготовления вакцин, в производственных подразделениях хранят в отдельных помещениях. Вакцинные штаммы в коллекциях — в отдельном холодильнике (шкафу), где отсутствуют другие ПБА; в исследовательских и диагностических подразделениях — в отдельных емкостях.
3.3. Требования к порядку передачи ПБА внутри организации
3.3.1.Передача ПБА I — IV групп внутри подразделения от одного сотрудника другому осуществляется по письменному разрешению его руководителя.
3.3.2.Передачу ПБА I — II групп из одного подразделения в другое следует осуществлять по письменному разрешению руководителя организации, а III — IV групп — по письменному запросу и разрешению руководителей подразделений.
3.3.3.Выдачу ПБА I — II и коллекционных штаммов микроорганизмов III — IV групп необходимо оформлять актом (ф. № 523/у) и записью в журнале (ф. № 516/у) для специализированных коллекций.
3.3.4.При временном отсутствии сотрудника (отпуск, командировка и др.) ответственным за хранение ПБА I — II групп является лицо, которому с разрешения руководителя организации (подразделения) ПБА передаются с правом или без права пересева с составлением акта (ф. № 524/у).
3.3.5. Передачу ПБА, числящихся за подразделением, на временное хранение в коллекцию следует осуществлять только по письменному распоряжению руководителя организации с составлением акта (ф. № 524/у).
3.4. Требования к порядку передачи ПБА за пределы организации
3.4.1. Передачу ПБА I — IV групп из одной организации в другую разрешается производить только по официальной заявке за подписью руководителя организации, скрепленной печатью. При обозначении требуемых агентов используют принятую номенклатуру (приложение 5.4). В заявке на получение ПБА I — IV групп делают ссылку о наличии разрешения на работу с микроорганизмами с указанием номера и даты выдачи. Передача производится только с письменного разрешения руководителя организации, выдающего ПБА, с составлением акта (ф. № 525/у).
3.4.2. Транспортирование ПБА I — IV групп между организациями осуществляется почтовой связью или нарочным(и).
При получении ПБА нарочный(е) должен(ы) представлять доверенность и документы, удостоверяющие его (их) личность. Нарочный(е) несет(ут) ответственность за доставку ПБА в установленном законом порядке.
3.4.3. ПБА I — II групп пересылают спецсвязью или с двумя нарочными, знакомыми с требованиями биологической безопасности, причем один из них должен иметь медицинское (биологическое, ветеринарное) образование и быть допущен к работе с ПБА I — II групп.
3.4.4. ПБА III — IV групп разрешается пересылать обычной почтовой посылкой или с одним нарочным.
3.4.5. При транспортировании ПБА I — IV групп в целях исключения всех видов досмотра и контроля нарочному должна быть выдана справка (приложение 5.6).
3.4.6. На содержимое упаковки с ПБА I — IV групп составляют сопроводительное письмо на официальном бланке организации. Для ПБА I — II групп дополнительно составляют акт упаковки в двух экземплярах. Первые экземпляры указанных документов помещают в упаковку с ПБА. Копии документов остаются у отправителя. Организация, получившая ПБА I — II групп, должна составить акт вскрытия упаковки и вместе с письмом, подтверждающим получение ПБА, направить его в организацию их выдавшую.
3.4.7. Организация-отправитель обязана сообщить любым видом срочной связи организации-получателю дату и вид транспорта, которым отправлен ПБА.
3.4.8. ПБА I — IV групп передают в лиофилизированном состоянии или на плотных питательных средах. Передача токсинов, вирусов (органов, тканей и их суспензий, содержащих эти ПБА) допускается в консервирующей жидкости или в замороженном состоянии.
3.4.9. Транспортирование ПБА осуществляется в герметически закрытых емкостях.
Под герметически закрытыми емкостями следует понимать запаянные ампулы, пробирки, завальцованные флаконы, запечатанные трубки из толстого стекла или пластического материала, а также пробирки, закрытые пробкой и герметизированные различными пластификаторами (парафин и др.).
Емкости с ПБА заворачивают в лигнин или гигроскопическую вату, помещают в металлический или пластмассовый (только для III — IV групп) плотно закрывающийся или завинчивающийся пенал. Упаковка емкостей с ПБА в пенале должна исключать возможность их перемещения во избежание нарушения целостности при транспортировании, а поглощающий материал должен быть в достаточном количестве для сорбции всей жидкости в случае повреждения упаковки.
Пеналы с упакованными в них емкостями, содержащими ПБА I — IV групп, обертывают бумагой (обшивают материалом), ошнуровывают и опечатывают сургучной печатью.
Для пересылки объектов почтой или спецсвязью упакованные пеналы дополнительно обертывают ватой и укладывают в прочные деревянные посылочные ящики так, чтобы исключить возможность их перемещения внутри ящика. Ящик с ПБА I — II групп обшивают тканью и обязательно опечатывают сургучной печатью или пломбируют.
На адресной стороне ящика посылки должен быть особый знак (ярлык с отметкой) «Опасно! Не открывать во время перевозки».
3.4.10. Перевозка живых животных и членистоногих, зараженных ПБА I — IV групп, категорически запрещается.
3.4.11. В случае возникновения при транспортировании ПБА I — IV групп аварий, катастроф, утраты и хищения посылок необходимо сообщать в органы государственного санитарно-эпидемиологического надзора, органы ФСБ, МВД, для принятия мер по охране места происшествия, ликвидации последствий, организации розыска потерянного или похищенного. Об этом факте информируют организации-отправителя и организации-получателя ПБА.
3.5. Требования к порядку передачи ПБА в зарубежные страны
3.5.1. ПБА I — IV групп разрешается передавать за рубеж и получать только при наличии официального запроса и разрешения на передачу.
3.5.2. Разрешение на передачу ПБА за рубеж, кроме упомянутых в приложении 5.2, дают министерства и ведомства на основании заключения специализированных коллекций.
3.5.3. Организации, получившие ПБА из-за рубежа, должны информировать об этом специализированные коллекции.
3.5.4. Лица, получившие ПБА во время зарубежных командировок, обязаны зарегистрировать их в своей организации. Ответственность за выполнение настоящего требования несут лица, получившие и доставившие ПБА, а также руководитель организации.
3.5.5. Порядок экспорта ПБА, список которых утвержден Распоряжением Президента Российской Федерации от 14 июня 1994 г. № 298-рл (приложение 5.2), определен Постановлением Правительства Российской Федерации от 26 сентября 1994 г. № 1098 (приложение 5.3).
3.5.6. Ответственность за соблюдение правил и требований упаковки и транспортирования до пункта пересылки несет руководитель организации-отправителя. Руководители организаций несут ответственность за правильность упаковки и отправления ПБА через Международный почтамт в соответствии с действующими международными конвенциями и правилами.
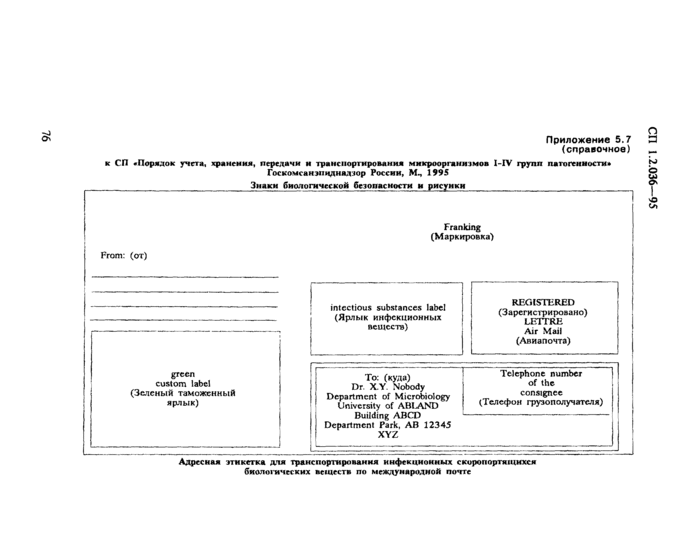
3.5.7. Сторона ящика, где указаны адреса получателя и отправителя, должна быть снабжена ярлыком фиолетового цвета со следующими отметками и отличительным знаком:
«СКОРОПОРТЯЩИЕСЯ БИОЛОГИЧЕСКИЕ ВЕЩЕСТВА»;
«Substances biologiques perissables»;
«Cette etiquette ne peut etre utiliser que par les laboratoires officielement reconnus» («этот ярлык может употребляться только официально признанными лабораториями»);
«Substances biologiques perissables usage medical» («скоропортящиеся биологические вещества для медицинского употребления»);
«Dangereux: Ne pas ouvrir pendant le transporte» («опасно: не открывать во время пересылки»);
«Sans valeur commerciale («не имеет коммерческой стоимости»);
«Emballe selon les regles postales internationales de securite» («упаковано согласно международным почтовым правилам безопасности»).
4. Организация контроля
4.1. Надзор за выполнением требований настоящих правил осуществляют органы Государственной санитарно-эпидемиологической службы Российской Федерации:
· Государственный комитет санитарно-эпидемиологического надзора Российской Федерации — в Противочумном центре Госкомсанэпиднадзора России;
· Противочумный центр — в организациях, выполняющих работу с ПБА I группы — на территории России;
· Противочумные учреждения Госкомсанэпиднадзора России (Противочумный центр, противочумные станции, научно-исследовательские противочумные институты) — в центрах Госсанэпиднадзора, выполняющих работы с ПБА II группы патогенности на прикрепленной территории;
· Центры Госсанэпиднадзора — в организациях, выполняющих работы с ПБА II — IV групп — на обслуживаемой территории.
4.2. Для проведения надзора руководители указанных в п. 4.1 организаций могут создавать на постоянной или временной основе комиссии, с привлечением специалистов центров Госсанэпиднадзора на территориях, профильных Научно-исследовательских институтов, противочумных и других организаций, имеющих опыт работы с ПБА I — IV групп.
4.3. В организациях, выполняющих работы с ПБА I — IV групп, постоянный контроль за выполнением настоящих правил осуществляет комиссия по контролю за соблюдением требований биологической безопасности организации с обязательной проверкой их выполнения не реже 2-х раз в год.
4.4. Организационное руководство по вопросам проведения контроля за выполнением настоящих правил осуществляет Противочумный центр Госкомсанэпиднадзора России.
4.5. Порядок контроля за организацией коллекционной работы определяется министерствами и ведомствами.
Приложение 5.1.
(обязательное)
к СП «Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности». Формы первичной учетной документации по учету движения и хранения ПБА
Код учреждения по ОКПО
|
ГОСКОМСАНЭПИДНАДЗОР РОССИИ Наименование учреждения _______________________ отдела, отделения _______________________________ лаборатории ___________________________________ временного формирования _______________________ |
Первичная учетная документация Форма № 512/у Утверждена постановлением Госкомсанэпиднадзора России от 28 августа 1995 г. № 14 |
Журнал регистрации патогенных биологических агентов, поступивших для исследования (идентификации) и хранения
Хранить 3 года
|
до |
|
начат |
|
окончен |
Для типографии при изготовлении документа
формат А4 96 страниц
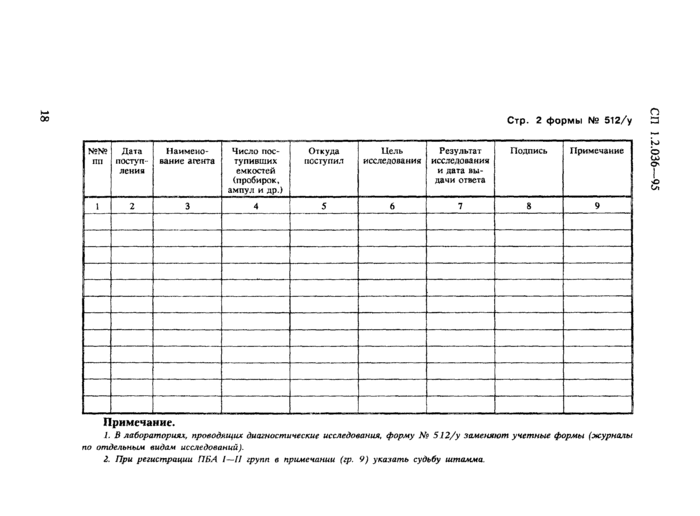
Стр. 2 формы № 512/у
|
№№пп |
Дата поступления |
Наименование агента |
Число поступивших емкостей (пробирок, ампул и др.) |
Откуда поступил |
Цель исследования |
Результат исследования и дата выдачи ответа |
Подпись |
Примечание |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
Примечание.
1. В лабораториях, проводящих диагностические исследования, форму № 512/у заменяют учетные формы (журналы по отдельным видам исследований).
2. При регистрации ПБА I — II групп в примечании (гр. 9) указать судьбу штамма.
Код учреждения по ОКПО
|
ГОСКОМСАНЭПИДНАДЗОР РОССИИ Наименование учреждения __________________ отдела, отделения __________________________ лаборатории ______________________________ временного формирования __________________ |
Первичная учетная документация Форма № 513/у Утверждена постановлением Госкомсанэпиднадзора России от 28 августа 1995 г. № 14 |
Журнал учета выделенных штаммов микроорганизмов
Хранить 3 года
|
до |
|
начат |
|
окончен |
Для типографии при изготовлении документа
формат А4 96 страниц
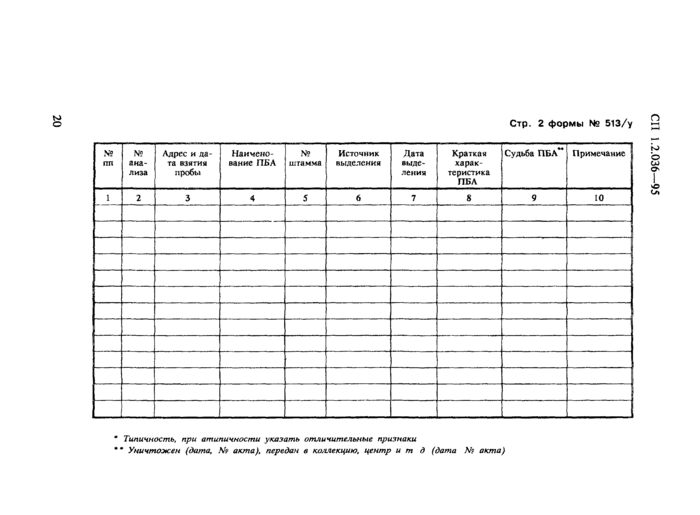
Стр. 2 формы № 513/у
|
№ пп |
№ анализа |
Адрес и дата взятия пробы |
Наименование ПБА |
№ штамма |
Источник выделения |
Дата выделения |
Краткая характеристика ПБА |
Судьба ПБА** |
Примечание |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|






